אימיד

בכימיה אורגנית, אימידים (באנגלית: Imides) הם קבוצה פונקציונלית המורכבת משתי קבוצות אציל המחוברות לאטום חנקן.[1] התרכובות דומות במבניהם לאנהידרידים, אך אימידים יותר עמידים בפני הידרוליזה. מבחינת שימוש מסחרי, אימידים משמשים בעיקר כרכיבים בפולימרים חזקים הנקראים פוליאימידים (אנ') הנחשבים כפלסטיק בעל ביצועים גבוהים. בנוסף קיימים אימידים אי-אורגנים הנמצאים בעיקר במצב צבירה מוצק או גז.
נומנקלטורה[עריכת קוד מקור | עריכה]
רוב האימידים הם תרכובות ציקליות הנגזרות מחומצות דיקרבוקסיליות (אנ'), ולכן גם שמם יגזר מחומצות אלו.[2] לדוגמה הסוקסינאימידים אשר נגזרים מהחומצה הסוקסינית, או הפתלאימידים הנגזרים מן החומצה הפתלית. עבור אמידים הנגזרים מאמינים נשים קידומת N. לדוגמה, N-ethylsuccinimide שנגזר מחומצה סוקסינית ואתילאמין (אנ'). למרות שמם הדומה, אין קשר בין האימידים לקרבודיאימידים (אנ') שנוסחתם הכימית היא מהצורה RN=C=NR.
אימידים מחומצות דיקרבקסיליות[עריכת קוד מקור | עריכה]
| n | שם נפוץ | שם סיסטמטי | מבנה | PubChem | החומצה ממנה נגזר | מבנה החומצה ממנה נגזר |
|---|---|---|---|---|---|---|
| 2 | סוקסינאימיד (אנ') | Pyrrolidine-2,5-dione | 
|
11439 | חומצה סוקסינית | 
|
| 2 | מאלאימיד (אנ') | Pyrrole-2,5-dione | 
|
10935 | חומצה מאלאית (אנ') | 
|
| 3 | גלוטראימיד (אנ') | Piperidine-2,6-dione | 
|
70726 | חומצה גלוטרית (אנ') | 
|
| 6 | פתלאימיד (אנ') | Isoindole-1,3-dione | 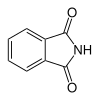
|
6809 | חומצה פתלית | 
|
תכונות[עריכת קוד מקור | עריכה]
בגלל שהאימידים קוטביים ביותר, הם מסיסים מאוד בממסים פולארים. אימידים הנגזרים מאמוניה[א], הם חומציים ויכולים להשתתף בקשרי מימן. בניגוד לאנהידרידים להם הם דומים מבנית, אימידים יכולים לעמוד בפני הידרוליזה, וחלקם אף יכולים להתגבש מחדש לאחר רתיחה במים.
מקורות ושימושים[עריכת קוד מקור | עריכה]
הרבה פולימרים בעלי חוזק רב או כאלו המוליכים חשמל טוב, מכילים תת-יחידות של אימידים. פולימרים אלו נקראים גם פוליאימידים (אנ'), כדוגמת הקפטון (אנ') לו יחידה חוזרת המכילה שני קבוצות אימידים הנגזרו מחומצה טטרהקרבוקסילית ארומטית.[3]

הכנה[עריכת קוד מקור | עריכה]
את רוב האימידים מכינים על ידי חימום חומצות דיקרבוקסיליות או על ידי חימום האנהידרידים שלהם עם אמוניה או אמין ראשוני, בתגובת דחיסה:
ניתן גם להכין אימידים על ידי חמצון אמידים, בעיקר לקטמים.[4]
חלק מהאימידים ניתן להכין גם בתגובת השחלוף מומ (אנ') אשר הופכת איזואימידים לאימידים.
תגובות[עריכת קוד מקור | עריכה]

בכימיה אורגנית[עריכת קוד מקור | עריכה]
עבור אימידים הנגזרים מאמוניה[א], המימן המחובר לחנקן הראשי הוא חומצה חלשה. לכן, ניתן להכין מלחי מתכת אלקלית של אימידים באמצעות בסיסים נפוצים כגון אשלגן הידרוקסידי (KOH). הבסיס הצמוד של פתלאימיד יהיה אשלגן פתלאימיד (אנ'). ניתן לעשות אלקילציה לאימידים בכדי ליצור N-alkylimides, אשר יכול להתפרק בתגובה שתשחרר אמין ראשוני. נוקליאופילים חזקים כמו אשלגן הידרוקסידי (KOH) או הידרזין (N2H4) משמשים בתגובת שחרור זו.
ניתן להגיב אימידים עם הלוגנים ובסיס ליצירת הלואימידים. לדוגמה N-Chlorosuccinimide (אנ') ו-N-Bromosuccinimide (אנ') המשמשים כמקור ל- ו- בסינתזה אורגנית.
בכימיה קואורדינטיבית[עריכת קוד מקור | עריכה]

בכימיה קואורדינטיבית קיימים קומפלקסים של מתכות מעבר עם ליגנדת NR2-.
ראו גם[עריכת קוד מקור | עריכה]
קישורים חיצוניים[עריכת קוד מקור | עריכה]
ביאורים[עריכת קוד מקור | עריכה]
הערות שוליים[עריכת קוד מקור | עריכה]
- ^ imides, IUPAC Compendium of Chemical Terminology (באנגלית)
- ^ A. V. Martynov, New Approach to the Synthesis of trans-Aconitic Acid Imides, ChemInform, 9 בנובמבר 2005 (באנגלית)
- ^ W.W. Wright, M. Hallden-Abberton, Polyimides, Ullmann's Encyclopedia of Industrial Chemistry, 15 ביוני 2000 (באנגלית)
- ^ J. Sperry, The Oxidation of Amides to Imides: A Powerful Synthetic Transformation, Synthesis, 27 בספטמבר 2011 (באנגלית)
| קבוצות פונקציונליות | ||
|---|---|---|
| פחמימנים | אלקיל (מתיל, אתיל, פרופיל, בוטיל, פנתיל) • אלקן (ויניל, אליל) • אלקין • קרבן • בנזיל • הלואלקאן • אלן • קומולן • פניל | 
|
| תרכובות חמצן | הידרוקסיל (כוהל) • קרבוניל • קטון • אלדהיד • אציל • קרבונט • חומצה קרבוקסילית • אנהידריד • אסטר • הידרופראוקסיד • פראוקסיד • אתר • המיאצטל • המיקטאל • אצטל • קטאל• חומצה דיקרבוקסילית • אצטיל • אצטוקסי • אקרילואיל • אלקוקסי (מתוקסי) • בנזויל • דיאוקסירן • אפוקסיד • אורתו-אסטר • ינון | |
| תרכובות חנקן | אמין • אמיד • קרבאמאט • אימין • אימיד • אזיד • אזו • ציאנט • איזוציאנט • ציאניד • ניטריל • איזוניטריל • הידרזון • ניטראט • ניטריט • ניטרו • ניטרוסו • אוקסים • פירידין • הידרזון • איזוניטריל • ניטרן | |
| תרכובות זרחן | פוספין • חומצה פוספונית • פוספאט • פוספודיאסטר | |
| תרכובות גופרית | תיול • תיואתר • דיסולפיד • סולפוקסיד • סולפון • חומצה סולפינית • חומצה סולפונית • תיוציאנט • איזותיוציאנט • תיוקטון • תיאל • תיואסטר • סולפונאמיד • פרסולפיד • תיוניל | |
| תרכובות ביוכימיות | חומצת שומן (ח.קרבוקסילית) • חלבון (פולי-אמיד) • פחמימה (קטון או אלדהיד) | |


![{\displaystyle {\ce {R(CO)NHCH2R' + 2[O] -> R(CO)N(CO)R' + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/15819940e8dc9c6cf169ad74b2beee9069b16173)

