קובץ:Events in alpha synuclein toxicity.jpg

גודל התצוגה המקדימה הזאת: 576 × 600 פיקסלים. רזולוציות אחרות: 230 × 240 פיקסלים | 461 × 480 פיקסלים | 737 × 768 פיקסלים | 1,200 × 1,250 פיקסלים.
לקובץ המקורי (1,200 × 1,250 פיקסלים, גודל הקובץ: 281 ק"ב, סוג MIME: image/jpeg)
היסטוריית הקובץ
ניתן ללחוץ על תאריך/שעה כדי לראות את הקובץ כפי שנראה באותו זמן.
| תאריך/שעה | תמונה ממוזערת | ממדים | משתמש | הערה | |
|---|---|---|---|---|---|
| נוכחית | 17:42, 28 באוגוסט 2009 | 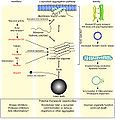 | 1,250 × 1,200 (281 ק"ב) | CopperKettle | {{Information |Description={{en|1=Events in α-synuclein toxicity. The central panel shows the major pathway for protein aggregation. Monomeric α-synuclein is natively unfolded in solution but can also bind to membranes in an α-helical form. It seems li |
שימוש בקובץ
הדף הבא משתמש בקובץ הזה:
שימוש גלובלי בקובץ
אתרי הוויקי השונים הבאים משתמשים בקובץ זה:
- שימוש באתר bs.wikipedia.org
- שימוש באתר da.wikipedia.org
- שימוש באתר en.wikipedia.org
- שימוש באתר en.wikibooks.org
- שימוש באתר en.wikiversity.org
- שימוש באתר fr.wikipedia.org
- שימוש באתר gl.wikipedia.org
- שימוש באתר ja.wikipedia.org
- שימוש באתר outreach.wikimedia.org